طرق التعبير عن تركيز المحاليل methods expressing concentrations
طرق التعبير عن تركيز المحاليل methods expressing concentrations
تعرف على علم الكيمياء 10 months ago [url=http://www.learnchemistry12.com/search/label/%D8%A7%D9%84%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1 %D8%A7%D9%84%D8%AA%D8%AD%D9%84%D9%8A%D9%84%D9%8A%D8%A9]الكيمياء التحليلية[/url], [url=http://www.learnchemistry12.com/search/label/%D8%A7%D9%84%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1 %D8%A7%D9%84%D8%B9%D8%A7%D9%85%D8%A9]الكيمياء العامة[/url], [url=http://www.learnchemistry12.com/search/label/%D9%85%D8%B9%D9%84%D9%88%D9%85%D8%A7%D8%AA %D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A6%D9%8A%D8%A9]معلومات كيميائية[/url]
المحلول عبارة عن خليط متجانس من مادتين أو أكثر لا يحدث بينهما تفاعل كيميائي ، وهو عبارة عن نظام ذي طور أو صنف واحد . ذو بانية مادة في أخرى لتكوين محلول متجانس يعتمد على طبيعة المواد المتضمنة في عملية الذوبان ، وتتأثر الذوبانية بالتغيرات في درجة الحرارة وبطبيعة المواد المكونة للمحلول والضغط ، بالرغم من أن المؤثر الأخير ذو أهمية بالنسبة للغازات فقط .
المادة الموجودة بوفرة في المحلول تسمى المذيب( solvent ) بينما الموجودة بنسبة أقل تسمى المذاب ( solute ) . ومع ذلك ، فإنه بالنسبة لمحلول صلب في سائل يشار دائماً للسائل بأنه المذيب ، علماً بأن هنالك حالات أخرى شاذة يكون فيها الصلب موجودا بكمية أكبر .
تركيز المحلول :
[rtl] يعبر عن النسبة بين كمية المذاب وحجم المحلول.[/rtl]
[rtl]ويمكن التعبير عن تركيز المحاليل بإحدى الطرق الآتية :
1- طريقة النسبة المئوية % ( V/V -W/W - W/V ) :
[/rtl]
النسبة المئوية الوزنية W/W : عدد جرامات المذاب في 100 مللتر من المحلول
مثال : محلول مائي تركيزه مثلاً 2% وزناً؛ هذا يعني أن كتلة المذاب 2 جرام في 100 مللتر من المحلول . يمكن تعيين النسبة المئوية بالوزن للمادة المذابة B في وزن معين من المذيب A كالآتي :
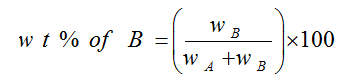 [rtl]
[rtl]
[/rtl]
[/rtl]

2- المولارية ... Molarity :
هي عدد مولات المذاب في 1000 مللتر من المحلول. المولارية = عدد مولات المادة المذابة/1000 مللتر من المحلول ، ويمكن حساب عدد مولات المذاب بالقانون التالي: عدد المولات = وزن المادة المذابة بالجرام/الوزن الجزيئي للمادة المذابة .

[rtl]3- العيارية ... Normality [/rtl]
[rtl]ويرمز لها بالرمز N وهي عبارة عن عدد الجرامات المكافئة من المادة المذابة في لتر من المحلول .
[/rtl]  [rtl]
[rtl]
4- المولالية ... Molality
هي عبارة عن نسبة عدد مولات المذاب إلى 1000 جرام من المذيب. المولالية = عدد مولات المذاب/ 1000جم من المذيب، وعدد المولات تُحسب بنفس الطريقة السابقة .[/rtl]

5- الكسر المولي .... Mole fraction
ويُرمز له بالرمز x . ويعرف الكسر المولي x لأي مكونة في المحلول بأنه عدد مولات تلك المكونة مقسوماً على عدد المولات الكلية لجميع مكونات المحلول . إذا اقترضنا أن nA مول من مذاب A ، وأن nB مول من مذاب B قد أذيبت في nC مول من المذيب CC فإن الكسر المولي لكل من هذه المكونات الثلاث يُعبر عنه كما يلي :
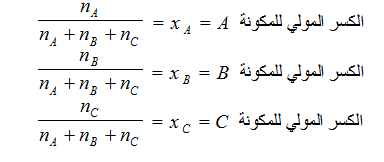
يلاحظ أن مجموع الكسور المولية للمكونات يساوي الوحدة

الدرس 3 : طرق التعبير عن التركيز methods expressing concentrations
https://www.youtube.com/watch?v=ZhcK133E7lU&feature=youtu.be
طرق التعبير عن تركيز المحاليل methods expressing concentrations
تعرف على علم الكيمياء 10 months ago [url=http://www.learnchemistry12.com/search/label/%D8%A7%D9%84%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1 %D8%A7%D9%84%D8%AA%D8%AD%D9%84%D9%8A%D9%84%D9%8A%D8%A9]الكيمياء التحليلية[/url], [url=http://www.learnchemistry12.com/search/label/%D8%A7%D9%84%D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A1 %D8%A7%D9%84%D8%B9%D8%A7%D9%85%D8%A9]الكيمياء العامة[/url], [url=http://www.learnchemistry12.com/search/label/%D9%85%D8%B9%D9%84%D9%88%D9%85%D8%A7%D8%AA %D9%83%D9%8A%D9%85%D9%8A%D8%A7%D8%A6%D9%8A%D8%A9]معلومات كيميائية[/url]
المحلول :
المادة الموجودة بوفرة في المحلول تسمى المذيب( solvent ) بينما الموجودة بنسبة أقل تسمى المذاب ( solute ) . ومع ذلك ، فإنه بالنسبة لمحلول صلب في سائل يشار دائماً للسائل بأنه المذيب ، علماً بأن هنالك حالات أخرى شاذة يكون فيها الصلب موجودا بكمية أكبر .
 |
[rtl] يعبر عن النسبة بين كمية المذاب وحجم المحلول.[/rtl]
 |
1- طريقة النسبة المئوية % ( V/V -W/W - W/V ) :
[/rtl]
النسبة المئوية الوزنية W/W : عدد جرامات المذاب في 100 مللتر من المحلول
مثال : محلول مائي تركيزه مثلاً 2% وزناً؛ هذا يعني أن كتلة المذاب 2 جرام في 100 مللتر من المحلول . يمكن تعيين النسبة المئوية بالوزن للمادة المذابة B في وزن معين من المذيب A كالآتي :
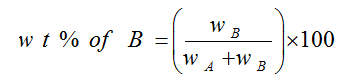
[/rtl]
النسبة المئوية الحجمية V/V : هي عبارة عن حجم المذاب في 100 مللتر من المحلول
مثال : محلول مائي تركيزه مثلاً 3% حجماً؛ هذا يعني أن حجم المذاب يساوي 3 مللتر مذابة في 100 مللتر من المحلول ، يمكن تعيين النسبة المئوية بالحجم للمادة المذابة B كما يلي :
[rtl]مثال : محلول مائي تركيزه مثلاً 3% حجماً؛ هذا يعني أن حجم المذاب يساوي 3 مللتر مذابة في 100 مللتر من المحلول ، يمكن تعيين النسبة المئوية بالحجم للمادة المذابة B كما يلي :
[/rtl]

2- المولارية ... Molarity :
هي عدد مولات المذاب في 1000 مللتر من المحلول. المولارية = عدد مولات المادة المذابة/1000 مللتر من المحلول ، ويمكن حساب عدد مولات المذاب بالقانون التالي: عدد المولات = وزن المادة المذابة بالجرام/الوزن الجزيئي للمادة المذابة .

[rtl]3- العيارية ... Normality [/rtl]
[rtl]ويرمز لها بالرمز N وهي عبارة عن عدد الجرامات المكافئة من المادة المذابة في لتر من المحلول .
[/rtl]

4- المولالية ... Molality
هي عبارة عن نسبة عدد مولات المذاب إلى 1000 جرام من المذيب. المولالية = عدد مولات المذاب/ 1000جم من المذيب، وعدد المولات تُحسب بنفس الطريقة السابقة .[/rtl]

5- الكسر المولي .... Mole fraction
ويُرمز له بالرمز x . ويعرف الكسر المولي x لأي مكونة في المحلول بأنه عدد مولات تلك المكونة مقسوماً على عدد المولات الكلية لجميع مكونات المحلول . إذا اقترضنا أن nA مول من مذاب A ، وأن nB مول من مذاب B قد أذيبت في nC مول من المذيب CC فإن الكسر المولي لكل من هذه المكونات الثلاث يُعبر عنه كما يلي :
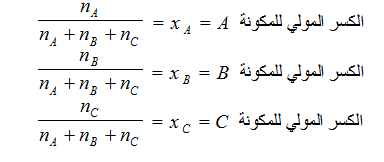
يلاحظ أن مجموع الكسور المولية للمكونات يساوي الوحدة

الدرس 3 : طرق التعبير عن التركيز methods expressing concentrations
https://www.youtube.com/watch?v=ZhcK133E7lU&feature=youtu.be

 الرئيسية
الرئيسية




